
הלב במחלת קרדיומיופתיה היפרטרופית
בעבודה זו ברצוני להביא לידיעת הציבור הרחב אינפורמציה עדכנית על מחלת לב גנטית בשם קרדיומיופתיה היפרטרופית (Hypertrophic Cardiomyopathy — HCM). ברצוני לאפשר גישה לאינפורמציה זו במיוחד לאנשים אשר במשפחתם התעוררו שאלות לגבי הימצאות מחלת לב זו, כאשר אחד מבני משפחתם אובחן במחלה או כאשר אחד מבני משפחתם נפטר על רקע לבבי ויש אפשרות שהמוות קרה בשל מחלה זו. אשמח אם אתרום בעבודה זו מידע עדכני לעוסקים בתחום הרפואי והפסיכולוגי בהתמודדותם בדרכי אבחון המחלה, דרכי הטיפול בה וההתמודדות עם משפחות בהם התגלה הגן הגורם למחלה.
אני רוצה לשתף אתכם במעורבות האישית והכואבת שלי במחלה. אני אתמקד בסיפור האישי ועל הפרטים הרפואיים אסביר בפרוטרוט בהמשך העבודה. כשבננו גלעד ז״ל נולד בשנת 1977 היה לו רשרוש חזק מאוד בלבו, שנבדק מיד ע״י מומחים בארה״ב, שם שהינו באותה התקופה, ולא נמצאה סיבה. כהורים מאד חרדים ואחראיים הלכנו להרבה מאד רופאים באופן קבוע ועשינו את כל הדרוש כדי להבין מה ואם יש בעיה בלבו של גלעד. כשגלעד היה בן 10 שמענו לראשונה על המחלה מרופא קופ״ח באחת מהבדיקות השגרתיות, בדיקת אקו עליה ארחיב בהמשך העבודה. בבדיקה זו ראה הרופא לראשונה התעבות של שריר הלב, ממצא שהצביע על מחלת הלב HCM אצל גלעד. מאותו רגע השתנו חיינו.
גלעד קיבל הוראות כיצד עליו להתנהג, במיוחד לגבי ספורט ואנחנו קיבלנו הוראות כיצד לעקוב אחרי המחלה, ע״י ביקורות במרפאה אחת לחצי שנה לצורך סידרת בדיקות. מאחר והמחלה ידועה כגנטית, חיפשו בבדיקות אקו אצל בעלי ואצלי ממי מאתנו הגיעה המחלה לבן, ולא נמצא אצל שנינו שום ממצא.
כשנה אחרי האבחנה אצל גלעד, בעלי חש ברע ואושפז ובאקו שנעשה נמצא ששריר הלב אצלו מעובה. מכאן הבנו כולנו שגם בעלי מאובחן במחלת HCM וממנו הגיעו הגנים לגלעד. מיד עלתה השאלה לגבי ילדינו האחרים, נדב ומיכל. הם נבדקו באקו ולא נמצאו שום ממצאים. מצבו של בעלי התדרדר להפרעות קצב קשות שנבעו מהמחלה ולכן בשנת 1995 הושתל בגופו דפיברילטור (מכשיר החייאה עליו כמובן ארחיב בהמשך) שבמשך השנה הראשונה להימצאותו בגופו הציל אותו ממות שלוש פעמים.
גלעד, נדב ומיכל המשיכו להיות בביקורות קבועות, כאשר הביקורות של גלעד היו תכופות יותר, אצל מומחים רבים. לצערנו הרב בלי שום הכנה ותוך שניות ביום חמישי, 27 ביוני, 1996, התמוטט גלעד ברחוב ונפטר למרות מאמצי מגן דוד להצילו. גלעד היה בן 19 וחמישה חודשים, סטודנט לארכיטקטורה בטכניון והיה כמעט בכניסה לטכניון כשהלך לעולמו.
הכאב העצום והדאגה הרבה לילדינו האחרים, גרמו לנו להיות מאד אסרטיביים בבקשות לאבחן אותם כחולים במחלת HCM או כלא חולים. לשמחתנו הוקמה, עקב מותו של גלעד, מעבדה מיוחדת לזיהוי המחלה בבית החולים הדסה עין כרם בירושלים. משפחתנו עברה מיפוי שתוצאותיו לא היו טובות, נדב ומיכל שניהם נושאים את הגנים של המחלה. מכאן מתחילה להתעורר בעיה מאד קשה לגבי המחלה. האם כל מי שנשא את הגן הפגום הוא נחשב חולה במחלה, ואם כן מה עושים מעכשיו כדי להגן עליו. בעיות עליהם ארחיב בעבודה בהמשך.
היום, במשפחתי גם נדב ומיכל, כמו בעלי, מושתלי דפיברילטורים וכולנו קנינו בכך קצת שקט נפשי למקרה בו אם יהיו הפרעות קצב המכשיר המושתל ייתן שוק חשמלי ללב ויעזור לו לחזור לפעולה.
דרכי ההתמודדות שלי ושל משפחתי עם הימצאות המחלה, חיפוש הגן הגורם למחלה, דרכי הטיפול והחיים עם השכול בשל המחלה הביאו אותי לכתוב עבודה זו שתסביר בפרוטרוט על המחלה, ההשלכות שלה ביום יום כולל זכויות וחובות (בצה״ל, בנסיעות לחו״ל, בנהיגה וכו׳) וכמובן דרכי האבחון והדילמות בדרכי הטיפול.
הלוואי ואוכל דרך אינפורמציה זו להגיע לאנשים שעבורם הידע יציל חיים.
חיפה, 5 במאי, 2003
קרדיומיופתיה היא קבוצת מחלות שריר הלב הבלתי דלקתיות. הפגיעה בשריר הלב, בצורתו ובתפקודו, בקבוצת מחלות זו היא הפרעה הולכת ומתקדמת המשנה את מבנה הדופן השרירי של החדרים, התאים התחתונים של הלב, או מחלישה את תפקודו. מחלות שריר הלב יכולות להתחיל כתוצאה ממחלות ידועות רבות (לדוגמא מחלת עורקים כליליים הגורמת למחלת שריר לב מוגדש ומורחב), וגם, לעיתים קרובות, כתוצאה מסיבות שאינן בנות זיהוי. קימות תת־קבוצות אחדות, הנבדלות זו מזו הן בסיבה לפגיעה בשריר הלב והן בתגובת השריר לפגיעה זו.
צורה אחת של קרדיומיופתיה, ייחודה בהתעבות ניכרת של שריר חדרי הלב. זוהי מחלת שריר לב היפרטרופי (מוגדל) הידועה בשפה הרפואית המקצועית כ־Hypertrophic Cardiomyopathy או HCM. בעבודה זו אני אדון רק בסוג זה של המחלה, כי ממנה סבל וכתוצאה ממנה נפטר בננו גלעד , וכן חולים במחלה זו בעלי ושני ילדינו האחרים.
שריר הלב אצל אנשים בריאים יכול להתעבות כתוצאה מלחץ דם גבוה או כתוצאה מאימון אתלטי מתמשך, לעומת זאת התעבות של שריר הלב בחולי מחלת HCM היא ללא סיבה הנראית לעין. בבדיקה מיקרוסקופית של שריר הלב של חולי HCM אפשר לראות שהשריר אינו נורמלי, חסר הסידור הנורמלי של תאי השריר.
הפרעה זו נקראת בלבול שריר הלב (Myocardial disarray) ואפשר לראות אותה בתמונה מס׳ 1 המשווה בין סידור מקביל של תאי שריר בלב נורמלי לבין אי סדר של תאי לב כפי שנמצאו בחלקי לב של חולי HCM.
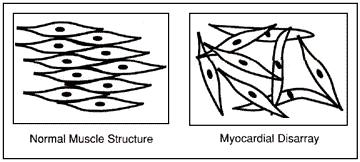
תמונה מס׳ 1
סדור התאים בשריר הלב
הקרדיומיופתיה ההיפרטרופית התגלתה לראשונה בשנות ה־50 המאוחרות. בתחילה מצב זה של הלב קיבל שמות רבים ביניהם: Hypertrophic Obstructive Cardiomyopathy (HOCM), Idiopathic Hypertrophic Sub-aortic Stenosis (IHSS), Muscular Sub-aortic Stenosis.
השם הנפוץ ביותר כיום הוא קרדיומיופתיה היפרטרופית (HCM).
מחקרים אחרונים בארה״ב מעידים שמחלה זו יותר שכיחה ממה שדווח קודם לכן. היום משוער שבערך אחד מכל 500 מהאוכלוסיה בבריטניה ובארה״ב סובל מהמחלה. לשם השוואה ראוי לציין שממחלת הסיסטיק פיברוזיס סובל אחד מכל 3300 מהאוכלוסיה בארצות אלה, כלומר מחלת HCM שכיחה ממנה פי 7 לערך.
הלב במחלת קרדיומיופתיה היפרטרופית
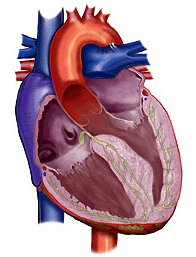
על מנת להבין מה קורה ללב במחלה, כדאי שנבין קודם את המבנה והתפקוד של לב נורמלי. תמונה מס׳ 2 מראה לב נורמלי ומתארת את חדרי הלב (ventricle) ועליותיו (atrium), ואת המסתמים (valve). קירות הלב מורכבים משריר מיוחד שנקרא מיוקרדיום (myocardium). חלק זה של הלב הוא זה ששונה מהנורמלי במחלת ה־HCM. החצים בדיאגרמה מראים את כוון זרימת הדם דרך הלב: העלייה הימנית מקבלת דם מהגוף, מעבירה אותו לחדר הימני ששואב אותו לריאות כדי שיקבל חמצן. הדם חוזר מהריאות לעליה השמאלית. הוא מועבר לחדר השמאלי ששואב אותו לגוף למחזור נוסף.
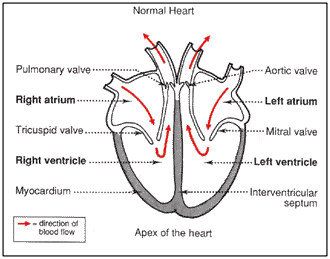
תמונה מס׳ 2
זרימת הדם בלב נורמלי
תמונה מס׳ 3 מראה את הפעילות החשמלית בלב נורמלי. כל פעימת לב נוצרת מאות חשמלי שמתחיל מלמעלה ועובר למטה לאורך הלב. בדיאגרמה ניתן לראות את האות החשמלי המתחיל בעלייה הימנית וממשיך לאורך החצים דרך הלב ברקמה מוליכה מיוחדת עד הגיעו לשריר כדי להתחיל התכווצות. אי התקינות של שריר הלב ב־HCM יכולה לפעמים להפריע לפעילות החשמלית התקינה הזאת. בקטעים הבלתי תקינים של הלב האות החשמלי יכול לההפך לבלתי יציב כאשר הוא עובר שטחים של צילוק (fibrosis) ותאים עם בלבול (disarray). זה גורם להתקפים חשמליים ללא סדר שיכולים לגרום לקצבי לב מהירים או לא סדירים.
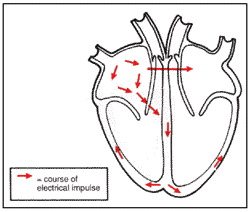
תמונה מס׳ 3
פעילות חשמלית בלב נורמלי
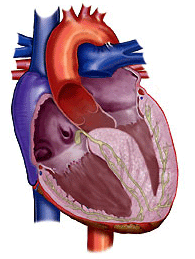
אי התקינות העיקרית של הלב ב־HCM היא ההתעבות הבולטת של השריר. התפלגות התעבות השריר, ההיפרטרופיה, היא משתנה. החדר השמאלי מושפע כמעט תמיד, ואצל כמה חולים במחלה מעובה גם שריר החדר הימני. בתמונה מס׳ 4 נראה את הצורה השכיחה ביותר של HCM שבה ההתעבות קורה בעיקר במחיצה (septum), הקיר המפריד בין החלק השמאלי והימני של הלב. ההתעבות קורה בעיקר בחלק העליון של המחיצה הקרוב למסתם המיטרלי (המקשר בין החדר השמאלי והעלייה השמאלית של הלב). התעבות זאת נקראת אסימטרית. אם ההתעבות איננה גדולה היא איננה מפריעה לפעילות המסתם ואומרים שהמחלה היא ללא חסימה (obstruction).
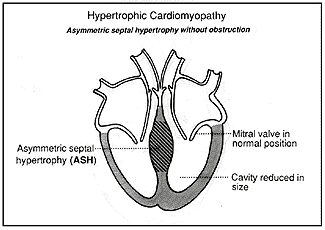
תמונה מס׳ 4
היפרטרופיה אסימטרית ללא חסימה
בתמונה מס׳ 5 נראה מה קורה כאשר ההתעבות גדולה יותר. בזמן שהדם מוזרק מהלב המסתם המיטרלי נוגע במחיצה (שבדרך כלל צריך להיות רווח ניכר בניהם כמו בתמונות הקודמות) ונוצרת היצרות של דרך הזרימה החוצה שמפריעה להזרקה התקינה של הדם. תופעה זו נקראת SAM (באנגלית: Systolic Anterior Motion) של המסתם המיטרלי. במקרה זה אנו אומרים שהמחלה היא עם חסימה. נוצרת תנועה מערבולתית של הדם שאפשר לשומעה כאוושה בסטטוסקופ. במקרים מסוימים המצב הלא תקין של המסתם המיטרלי גורם לדליפה (regurgitation) של המסתם ולאוושה נוספת.
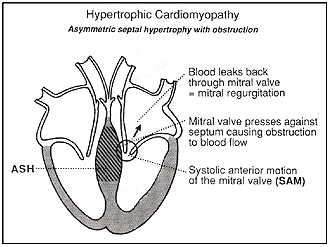
תמונה מס׳ 5
היפרטרופיה אסימטרית עם חסימה
בערך ברבע מהחולים ההתעבות מתחלקת במידה שווה על כל קירות החדר השמאלי. מקרה זה ידוע בשם היפרטרופיה סימטרית או קונצנטרית. בחלק קטן מהחולים, בערך ב־10% , ההתעבות היא בעיקר בחוד הלב וקרויה היפרטרופיה חודית (apical). מקרה זה שכיח יותר ביפן מאשר במערב. לחולים עם היפרטרופיה סימטרית או חודית אין בדרך כלל אוושה. תמונות מס׳ 6 ומס׳ 7 מתארות שני מקרים אלה.
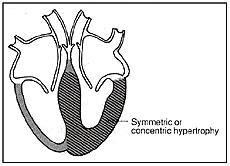
תמונה מס׳ 6
היפרטרופיה סימטרית
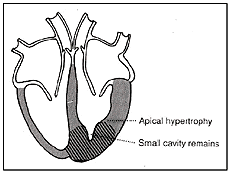
תמונה מס׳ 7
היפרטרופיה חודית
השריר המעובה מתכווץ בדרך כלל היטב ומזריק את רוב הדם מתוך הלב. לעומת זאת השריר הוא לעיתים קרובות נוקשה ומתרחב בצורה גרועה ודורש לחצים גבוהים מהתקין כדי להתרחב עם כניסת הדם לתוך הלב. כמות הדם, על כן, שהלב יכול להכיל מצטמצמת וזה יגביל בהמשך את כמות הדם שתוזרק בהתכווצות הבאה. לעיתים לחולים אין כמעט התעבות, אבל יש להם הגבלות קשות של זרימת הדם לתוך החדרים. לכן לעיתים קשה לזהות את המחלה האמיתית של חולים אלה.
לסיום, חשוב לשים לב שחלקים של הלב שנפגעים לעיתים קרובות ע״י מחלות לב אחרות, כמו מסתמי הלב והעורקים הכליליים (כלי הדם המספקים את תצרוכת הלב) לא נפגעים ע״י מחלה זו.
אין תסמין או תלונה שהם ייחודיים רק ל־HCM. הסיבה להתפרצות של תסמינים היא לעיתים לא ברורה. הם יכולים לקרות בכל שלב בחיים, בעוד שהמצב הלא תקין יכול שהתקיים כבר במשך זמן מה קודם להופעת התסמין.
התסמינים יכולים לכלול:
תסמינים נוספים העלולים להופיע במחלה:
בדרך כלל רופא יכול לזהות מחלת שריר לב היפרטרופי ע״י בדיקה גופנית. למשל, כאשר הוא שומע מבעד לסטטוסקופ את קולות הלב האופייניים למחלה. בדרך כלל, האבחנה מאושרת ע״י אקוקרדיוגרמה (בקיצור „אקו“), אלקטרוקרדיוגרמה (אק״ג) או צילום רנטגן של החזה. כאשר שוקלים ניתוח מתעורר לעיתים הצורך בצינתור הלב כדי למדוד לחצים בתוך הלב. בהמשך העבודה נדון גם בבדיקות נוספות, כמו בדיקות גנטיות, לזיהוי המחלה אצל בני המשפחה של החולה ב־HCM, כולל זיהוי המחלה אצל עוברים.
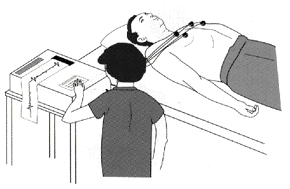
תמונה מס׳ 8
אלקטרוקרדיוגרמה
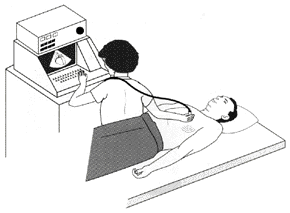
תמונה מס׳ 9
אקוקרדיוגרמה
בדיקות נוספות נחוצות בדרך כלל כדי להעריך את התסמינים, את הסכנה לסיבוכים, במיוחד מווות פתאומי, וכדי לבחור את הטיפול הטוב ביותר.
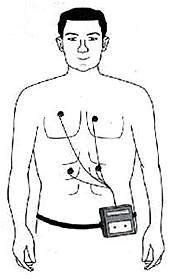
תמונה מס׳ 10
בדיקת הולטר
מחלת שריר לב היפרטרופי עלולה להיות פגם מלידה. היא עלולה לקרות אצל מבוגרים הלוקים באקרומגליה, מצב הנובע מנוכחות של עודפי הורמון גדילה בדם, או אצל אנשים שיש להם פיאוכרומוציטומה, גידול המייצר אדרנלין. אנשים הלוקים בניורופיברומטוזיס, מצב העובר בתורשה, יכולים גם הם לפתח מחלת שריר לב היפרטרופי. על מקרים מיוחדים אלה לא נרחיב את הדיבור בעבודה זו מאחר שברוב המקרים, ההתעבות של שריר הלב ב־HCM נובעת מפגם גנטי תורשתי. במשפחות הנפגעות המחלה מועברת מדור לדור בלי שום דילוג. סוג זה של תורשה נקרא דומיננטי ומועבר מזכרים ונקבות חולים לצאצאיהם ללא אבחנת מין. לכל ילד יש 50% סיכוי לרשת את המחלה . בתמונה מס׳ 11 נראה עץ משפחה עם 4 דורות הפגועים ב־HCM. זכרים מסומנים ברבוע ונקבות בעיגול כאשר הצורה המלאה מראה אדם שלקה במחלה.
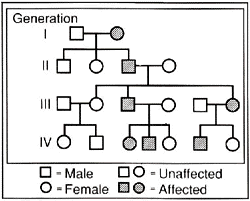
תמונה מס׳ 11
עץ של משפחה החולה ב־HCM
מחקרים בשנים האחרונות זיהו פגמים ב־10 גנים לפחות, שהם חשובים בהתפתחות תאי שריר הלב. פגם כזה ידוע בשם מוטציה ואפשר לדמותו לשגיאת כתיב בקוד הגנטי שיוצר ה־DNA. ב־50-60% מהמשפחות גילו שלאנשים הפגועים יש מוטציה בגן האחראי ליצירת אחד החלבונים החשובים להתכווצות של הלב: שרשראות החלבון הכבדות מסוג מיוזין אלפא ובטא, טרופונין, אלפא טרופו מיוזין ועוד. בתמונה מס׳ 12 רואים את המרכיבים החלבוניים של הסרקומר שהוא יחידת הכווץ של הלב, ואת השכיחות של המוטציות במרכיבים אלה אצל חולי HCM.
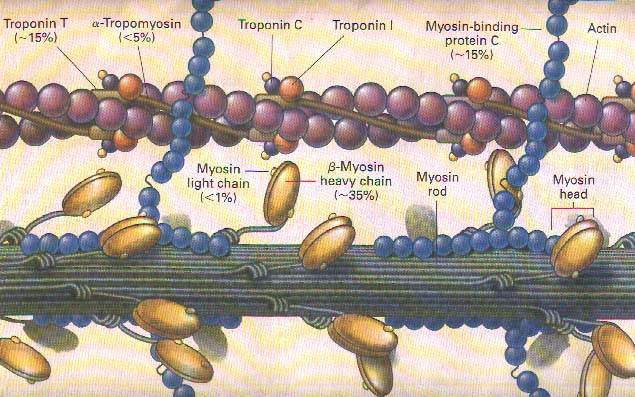
תמונה מס׳ 12
מרכיבי הסרקומר
בחלק מן המקרים יכולים להיות מספר סיבוכים ספציפיים למחלה וביניהם:
כיום לא ניתן לרפא את המחלה למרות שיש סיכוי קטן שכמה תרופות אולי תקטנה את דרגת ההתעבות של השריר. לצערנו שום טיפול לא נמצא עד היום שיחזיר את הלב למבנהו התקין אבל המחקר ממשיך בכוון הזה. רוב ההתפתחויות קרוב לוודאי תבואנה בזיהוי מוקדם של האנשים הנושאים את הגנים של HCM ובטיפול בהם כדי למנוע את התפתחות המחלה.
מטרת הטיפול היא בעיקר לשפר את התסמינים ולמנוע סיבוכים. למרות שאי אפשר לרפא את המחלה יש צורות שונות של טיפול שיכולות לשפר את פעילות הלב ולהקל על החולה. הטיפולים מתחלקים לשלוש קבוצות: טיפול תרופתי, טיפול ניתוחי וטיפולים אחרים.
טיפול תרופתי: ניתן בעיקר כאשר החולה יש לו כמה או את כל התסמינים שמנינו קודם. בחירת הטיפול התרופתי משתנה מחולה לחולה אבל הקבוצות העיקריות של התרופות ושימושיהן הן כדלהלן:
לסיכום , משתמשים כיום במגוון רחב של תרופות לטיפול ב־HCM וכמובן תרופות חדשות מתגלות מיום ליום. הצורך בטיפול כל שהוא והבחירה של הטיפול המתאים צריכה להיעשות על בסיס אינדיבידואלי, ויכולה להשתנות אצל אותו חולה במשך השנים בהתאם למצבו ובהתאם למבחר התרופות הקיים. נעיר כי גם כשאין תסמינים אם עובי המחיצה הבין חדרית הוא מעל 35 מ״מ מומלץ להתחיל בטיפול תרופתי.
טיפול ניתוחי: נעשה בחולי HCM שלמרות הטיפול התרופתי המרבי ממשיכים לסבול מתסמינים או בחולים שמועמדים לניתוח עקב מחלות לב אחרות. הניתוח המקובל הוא כריתת המחיצה הבין חדרית. בניתוח זה מסיר המנתח חלק מהשריר המעובה של המחיצה וע״י כך מרחיב את דרך המעבר של הדם היוצא ומקל על החסימה. לניתוח זה סיבוכים שונים כמו יצירת חסם הולכה לבבי ויצירת פגמים במחיצה הבין חדרית (VSD), אם מורידים יותר מדי מהמחיצה. טיפול ניתוחי נוסף אצל חולי HCM הוא החלפת המסתם המיטרלי במסתם מלאכותי. כמו שהסברנו קודם, בזמן החסימה לזרימת הדם החוצה מתוך הלב המסתם המיטרלי נוגע במחיצה והדם דולף בחזרה דרך המסתם. אם הדליפה הזו חמורה יש צורך להחליף את המסתם.
כל הניתוחים הנ״ל הם בעלי סיכון ניכר לכן מתאימים לחולים עם תסמינים חמורים וסוגים מסוימים של HCM. לאחרונה התחיל השימוש בפרוצדורה חדשה שהיא כריתת המחיצה לא בדרך ניתוחית. מטרתה להקטין את ההתעבות של החלק העליון של המחיצה ללא צורך בניתוח לב פתוח . טכניקה זו כוללת הזרקת כמות קטנה של תמיסת אלכוהול לתוך סעיפים של העורק הכלילי שמזין את המחיצה העליונה וע״י כך היא משמידה את החלק הזה של שריר הלב. זה נעשה תוך כדי צנתור לבבי ויכול להיעשות בהרדמה מקומית. למרות שתהליך זה בשלביו הראשונים של הפיתוח הוא ייתן תוספת חשובה לטיפולים הלא ניתוחיים שעומדים לרשות חולים עם תסמינים של HCM.
במקרים מעטים בחולים שהטיפול הניתוחי והתרופתי נכשלו והם הגיעו לאי ספיקת לב (כלומר שהלב מפסיק לתפקד כמשאבה) יתכן שיש צורך בהשתלת לב.
טיפולים אחרים: יש כמה צורות נוספות של טיפול המומלצות לעיתים ב־HCM. נמנה אותן בקצרה:
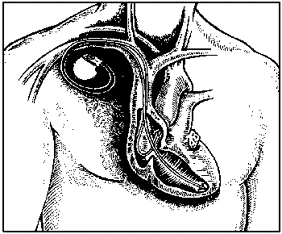
תמונה מס׳ 13
קוצב לב
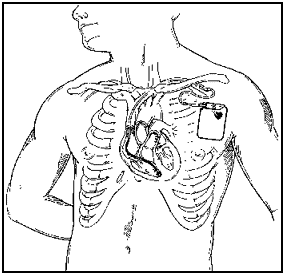
תמונה מס׳ 14
דפיברילטור
מאחר ש־HCM היא בדרך כלל מחלה גנטית משפחתית, נשאלת תמיד השאלה: אם ידוע על חולה HCM במשפחה, מה יש לעשות כדי „לסנן“ את המשפחה ולזהות חולי HCM נוספים?
בדיקת גנים במעבדה, הנעשית על 10 סמ״ק דם הנלקחים מכל אחד מבני המשפחה, היא, לפחות תאורטית, השיטה הוודאית ביותר לזהות את אותם פרטים שלקו במחלה, דהיינו, בעלי הגן הפגום. עם זאת, בדיקות מעבדה אלה הן יקרות, לא שגרתיות, ולא מבטיחות תשובה חיובית. בדיקה גנטית מוגבלת היום למספר מצומצם מאוד של מעבדות מחקר, שעובדות על מספר קטן של משפחות, בעיקר לצורכי מחקריהן. לכן, הסינון המשפחתי עדיין מתבצע היום כמו שהתבצע שנים רבות, ע״י סדרת אקוקרדיוגרמות הנעשות בצורה מחזורית לילדים הגדלים במשפחות עם HCM. מטרת ה„אקו“ היא לזהות את התסמין האופייני ביותר של HCM, דהיינו התעבות המחיצה הבין חדרית.
בקווים כלליים, ההתעבות בדרך כלל איננה ניכרת לפני גיל 10, והסיכוי המרבי לגלותה הוא אחרי גיל 12. עובי הקורות של הלב גדל בדרך כלל בקצב מואץ בגיל ההתבגרות. שינויי העובי יכולים להיות מאד חדים וצורת הלב יכולה להשתנות לגמרי בין גיל 12 לגיל 14 — לעתים משתנה מתקינה לחלוטין לעבה מאוד. מומחים מאמינים ששינויים אלה, למרות שהם מאוד מפחידים את המשפחה ולעיתים גם את הרופאים, הם המבנה הרגיל אותו מקבל הלב ההיפרטרופי, ואינו מהווה, בפני עצמו, סימן של הידרדרות או אות לסכנה מידית. אם ההתעבות איננה מוסברת בדרכים אחרות (כמו אימון אתלטי או מחלה אחרת), ניתן להסיק כי ההתעבות מעידה על מוטציה גנטית האחראית ל־HCM. עד כה האמינו, בהסתמך על נתונים שנאספו, כי אם היפרטרופיה לא נצפתה עד שהילד הגיע לבגרות וגידול גופני מלאים (בגיל 17-19 לערך), הסיכויים שתופיע יותר מאוחר הם קטנים. עם זאת, נתונים חדשים מצביעים על האפשרות שהתפרצות בוגרת של המחלה יותר שכיחה ממה שחשבו תחילה. לכן, ממומלץ להמשיך את הסינון גם אחרי גיל 25, כל 5 שנים, במשך כל החיים.
מתי יש לבצע את האקוקרדיוגרמה אצל ילדים במשפחות עם HCM ? אקוקרדיוגרמות מסננות לפני גיל 10 או 12 הן רשות, מאחר שבדיקות אלה הן חיוביות לעתים רחוקות בגיל זה, ואפילו נוכחות של מוטציה של HCM וידיעה על המחלה בגיל זה לא תוביל בהכרח להתערבות. יוצאות מן הכלל יהיו משפחות בהן קרו כמה מקרים של מוות פתאומי כתוצאה מ־HCM, או אם הילד הוא אתלט המתאמן לתחרויות. במקרים אלה אקוקרדיוגרמות בגיל צעיר הן מחייבות, מאחר ש־HCM היא הגורם החשוב ביותר למוות פתאומי תוך כדי ספורט אצל אנשים צעירים, והיא מהווה סיבה לפסילה מאימון ותחרות.
במקרים אחרים, ממומלץ לבצע סדרת אקוקרדיוגרמות כל 18 חודשים בערך (או כל 12 חודשים אם הילד אתלט מתאמן) עד סוף תקופת ההתבגרות או עד שהאקוקרדיוגרמה הופכת מתקינה למעובה. כדאי לצין כי הרישום החשמלי מהלב, האק״ג, יכול להיות לא תקין אצל ילד נגוע גנטית הרבה לפני שהאקוקרדיוגרמה תהיה לא תקינה. עד היום, דווח על מעט מאוד חולים מבוגרים שהיתה להם אקוקרדיוגרמה תקינה אחרי גיל 18, ואשר הפכה ללא תקינה רק מאוחר יותר.
הטבלה הבאה מסכמת את ה־„מי, מתי, איך?“ של הסינון המשפחתי:
החברה הקרדיולוגית בישראל — החוג למחלות שריר הלב והפריקרד, רח׳ שטראוס 5, ת.ד. 492, ירושלים 91004, טלפון: 02-6464124, פקס: 02-6242076 .
הארגון הוקם ומנוהל ע״י פרופ׳ אנדרה קרן מהמחלקה הקרדיולוגית ע״ש היידן, ביה״ח ביקור חולים, ירושלים, בשיתוף פרופ׳ ערן לייטרסדורף מהמרכז הרפואי הדסה עין־כרם.
הארגון מרכז את פרויקט ה־ISAAC (באנגלית: Israeli Shared Action for Advancement of Cardiomyopathies), שמטרותיו הקמת מאגר נתונים יהודי של חולים עם קרדיומיופתיה המשותף לכל המחלקות הקרדיולוגיות בישראל, והקמת בנק DNA לחולים עם קרדיומיופתיה היפרטרופית ותחילת המיפוי הגנטי שלהם. הנתונים הקליניים של החולים עם קרדיומיופתיה מועברים למחלקת הלב של ביה״ח ביקור חולים, המשמש כמרכז הזרוע הקלינית של המחקר, שם הם עוברים ביקורת, תוך שמירה קפדנית על סודיות רפואית לגבי זהות החולים, ומצורפים לתוך המאגר הממוחשב לשימוש כל המחלקות הקרדיולוגיות באמצעות רשת תקשורת ממוחשבת. בעת ההערכה הקלינית, מרוכזות דגימות ה־DNA של החולים ומשפחותיהם במרפאה לייעוץ גנטי של ביה״ח הדסה עין־כרם, בראשותה של ד״ר ורדיאלה מינר. במקרה שבזמן הסקירה הגנטית לגבי הגנים העיקריים המעורבים במחלה לא נמצאת מוטציה מוכרת, מועברות דגימות DNA לביה״ח St. George בלונדון להמשך ההערכה של גנים נוספים. נכון למאי 2003, במאגר 348 פרטים, מהם 146 (42%) מזוהים קלינית כחולי HCM. חולי HCM, בני משפחותיהם, או מי שחושד בקיום המחלה במשפחתו עקב מוות פתאומי מדום לב, יכולים לפנות ישירות אל הארגון (אפילו טלפונית, למזכירה חנה), על מנת לקבל ייעוץ והפניה להמשך האבחון והטיפול במחלקה קרדיולוגית קרובה למקום מגוריהם, ובכך גם לתרום להמשך חקר המחלה.
דעת — שירותי מידע לבריאות, רח׳ צ׳ילי 6, קריית היובל, ירושלים, טלפון: 02-6416843, פקס: 02-6426528 .
הארגון, השיך לביה״ח הדסה, הוקם ומנוהל ע״י גב׳ נאוה דולב.
לשרות זה יכול לפנות כל אחד לצורך קבלת מידע בכל נושא רפואי, כולל מידע על HCM. המרכז כולל ספרים, עיתונים (כולל עדכון קרדיולוגי — ביטאון החברה הקרדיולוגית בישראל), עלונים, סרטי וידאו, מאמרים, תוכנית ממוחשבת וכניסה לאתרים דרך האינטרנט. אפשר לפנות אליהם טלפונית או בכתב ולבקש חומר, או לגשת למרכז הבריאות הקהילתי המחלקה לרפואה חברתית, בו ממוקם השרות. לעיתים אפשר לקבל מהשרות מידע רפואי שחלק מהרופאים לא מוסרים אותו למטופליהם. מידע זה יכול להעיד על צורך בקבלת חוות דעת רפואית נוספת או טיפול אלטרנטיבי.
המרכז הישראלי לעזרה עצמית, רח׳ המלך ג׳ורג׳ 37 ת.ד. 23223 תל אביב 61231,
טלפון: 03-6200259, פקס: 03-5254486. אתר אינטרנט: www.selfhelp.org.il ,
דוא״ל: selfhelp@netvision.net.il .
ארגון זה הוקם בחסות לנ״י (ליגת נשים למען ישראל) ופועל בסיוע ובתמיכת משרד העבודה והרווחה וג׳וינט ישראל. הוא מרכז מאגר מידע של שמות, כתובות ומספרי טלפון של ארגונים וגופים שונים בישראל המיועדים לסייע לחולים בתחומים ספציפיים כולל מחלות לב בכלל ו־HCM ודום לב בפרט. הרשימה מופיעה בספר מדריך ארגוני עזרה עצמית בישראל וגם בספר מרק — המדריך הרפואי השלם לבית ולמשפחה, אבל כדי לקבל את האינפורמציה העדכנית ביותר ניתן לפנות למרכז עצמו. כרגע מופיעים ברשימה לפחות שתי כתובות רלוונטיות לחולי HCM ומשפחותיהם: גלעד — דום לב , בטלפון: 04-8227605 שם אנחנו משוחחים עם הפונים אלינו, כהוריו של גלעד, על אפשרויות האבחון והטיפול במחלה הידועות לנו כתוצאה מניסיוננו המשפחתי. הקמנו גם אתר באינטרנט לזכרו של גלעד, הכולל מידע רב על המחלה וכתובתו Gilead.org.il ואנו מקבלים גם הרבה פניות בדואר אלקטרוני לפי הכתובת המופיעה באתר. קבוצת מושתלי דפיברילטור בביה״ח כרמל, חיפה, טלפון: 04-8250658 או 04-8250311. קבוצה זו נפגשת פעם או פעמיים בשנה לעדכונים, הרצאות ותמיכה הדדית. לקבוצה זו יכולים להצטרף גם חולים שעברו השתלת דפיברילטור בבתי חולים אחרים. ברשימה מופיעות גם כמה כתובות אחרות קשורות למחלות לב היכולות להיות רלוונטיות למחלת HCM במידה זו או אחרת.
עמותות לחולי HCM ומשפחותיהם: בארץ אין עדיין עמותה כזאת. לעומת זאת הוקמו עמותות כאלה בכמה ארצות. המקום הראשון בה הוקמה עמותה היה אנגליה, ואחריה ארה״ב. כל העמותות מקימות אתרים באינטרנט, הכוללים מידע עדכני רב על המחלה ואפשרויות הטיפול בה. הן מנוהלות בדרך כלל ע״י בני משפחה של חולים (שלעתים קרובות חולים בעצמם למרות שאינם סובלים עדיין מתסמיניה), לעתים קרובות לזכרם של חולים שנפטרו באופן פתאומי מדום לב, אבל המידע הרפואי שלהם מבוקר ע״י טובי החוקרים של המחלה. להלן רשימת העמותות:
מכוני הבריאות הלאומיים (The National Institutes of Health — NIH): שנוסדו ב־1887, הם נקודת המוקד הפדרלית של המחקר הרפואי בארצות הברית, ויש להם מאות פרסומים של הנחיות לגבי מחלות שונות, שכיחות ונדירות כאחד. כולם נגישים דרך האינטרנט. את אלה הקשורים ל־HCM ניתן למצוא בעקר באתרים הבאים:
האתר השלישי הוא הרלוונטי ביותר. פרטים נוספים על ה־NIH נתן למצוא בכתובת: www.nih.gov/about/NIHoverview.html.
בר, עמוס ורוזין, טלי, 1994. המדריך הישראלי להריון ולידה. תל אביב: זמורה ביתן.
ברקוב, רוברט (ער׳), 2002. מרק — המדריך הרפואי השלם לבית ולמשפחה. תל אביב: כנרת. עמ׳ 68-148, 1385-1396.
גליקסון, מיכאל ואלדר, מיכאל, 1998. חשיבותן של הפרעות קצב ושל הבדיקה האלקטרופיזיולוגית בחולים עם קרדיומיופתיות. עדכון בקרדיולוגיה, 18, 9-19.
זהבי, יזהר ושיינפלד, יהודה, 1989. הלב בבריאות ומחלה. תל אביב: הקיבוץ המאוחד.
לייטרסדורף, איריס ולייטרסדורף, ערן, 1997: גנטיקה מולקולרית של קרדיומיופתיה היפרטרופית משפחתית והשלכותיה הקליניות. עדכון בקרדיולוגיה, 16, 15-17.
מוסרי, מוריס, 1998. העורקים הכליליים בקרדיומיופתיות. עדכון בקרדיולוגיה, 18, 4-8.
מינר, ורדיאלה, 1998. פגמים גנטיים בקרדיומיופתיות וחשיבותם הקלינית. עדכון בקרדיולוגיה, 18, 20-26.
קרן, אנדרה ולייטרסדורף, ערן, 1998. ISAAC — הקמת מאגר מידע משותף לחולים ולמשפחות עם מחלת שריר לב ראשונית ותחילת תוכנית מיפוי גנטי למשפחות ישראליות עם קרדיומיופתיה היפרטרופית, עדכון בקרדיולוגיה, 18, 27-33.
קרן, אנדרה ומזוז, בנימין, 1996. ערכה ומגבלותיה של הבדיקה האקוקרדיוגרפית באבחון של קרדיומיופתיות קלאסיות ובלתי שגרתיות. עדכון בקרדיולוגיה, 13, 12-16.
רוגין, אריאל ורייסנר, שמעון, 1997. קרדיומיופטיה היפרטרופית — חידושים בגישה הטיפולית. עדכון בקרדיולוגיה, 17, 4-7.
רוזנהק, שמעון, 1996. הפרעות קצב הלב. ראש העין: פרולוג.
רמון, מרתה (ער׳), 2000. מדריך ארגוני עזרה עצמית בישראל. תל אביב: מרכז ישראלי לעזרה עצמית (מה׳ 2).
Maron, Barry J., 2002. Family Screening for HCM. HCMA Heart Link, 2, (10) 9.
Maron, Barry J. 2002. Cardiology patient page — Hypertrophic Cardiomyopathy. Circulation, 106, 2419. Full text: circ.ahajournals.org/cgi/content/full/106/19/2419.
Maron, Barry J., & Salberg, Lisa, 2001. Hypertrophic Cardiomyopathy: for patients, their families and interested physicians. Armonk, New York: Futura Media Services.
Maron, Barry J., Shen, Win-Kuan, Link; Mark S. & als, 2000. Efficacy of Implantable Cardioverter-Defibrillators for the prevention of sudden death in patients with Hypertrophic Cardiomyopathy. The New England Journal of Medicine, 342, 365-373. Abstract: content.nejm.org/cgi/content/abstract/342/6/365.
Parker, James N., & Parker, Phillip M. (eds)., 2002. The official patient’s sourcebook on Hypertrophic Cardiomyopathy — a revised and updated directory for thr Internet age. San Diego, California: ICON Health Publications.
Spirito, Paolo, Seidman, Chistine E., McKenna, William J., & Maron, Barry J., 1997. The management of Hypertrophic Cardiomyopathy. The New England Journal of Medicine, 336, 775-785. Full text: Gilead.org.il/hcm/ .
Spirito, Paolo, Bellone, Pietro, Harris, Kevin M., & als., 2000. Magnitude of left ventricular hypertrophy and risk of sudden death in Hypertrophic Cardiomyopathy. The New England Journal of Medicine, 342,1778-1785. Abstract: content.nejm.org/cgi/content/abstract/342/24/1778.